Ja, auch mit unterschiedlichen Stabilitäten!
Hierbei wird der Begriff „Halbwertszeit“ verwendet, um ein Atom oder Molekül zu beschreiben, das einem exponentiellen Zerfall unterliegt. Sie ist über die Lebensdauer der zerfallenden Einheit konstant. Anders beschrieben, bezieht sich der Begriff „Halbwertszeit“ auf jeden Zeitraum, in dem ein Molekül oder Atom um die Hälfte seiner „Lebensdauer“ abfällt, auch wenn der Zerfall nicht exponentiell verläuft.
Monoatomarer Sauerstoff:
O1 ist monoatomarer Sauerstoff und wird auch als „atomarer Sauerstoff“ oder „naszierender Sauerstoff“ bezeichnet. Es ist ein sehr starkes Oxidationsmittel. Man findet ihn nur in der Exosphäre (alias Weltraum), wo er sich durch Strahlung nicht mit allem verbindet, mit dem er in Kontakt kommen kann. Die einzelnen Atome des monoatomaren Sauerstoffs neigen dazu, sich schnell mit nahegelegenen Molekülen zu verbinden. Auf der Erdoberfläche existiert er in der Natur nicht sehr lange.
Der allgemein bekannte Sauerstoff O2:
Das gemeinsame Allotrop des elementaren Sauerstoffs auf der Erde wird als „Dio-Sauerstoff“ oder „diatomarer Sauerstoff“ bezeichnet. Das chemische Symbol ist „O2“. Dies ist die Form, die von komplexen Lebensformen, wie z.B. Tieren, in zellulären Atmung und es ist die Form, die einen wesentlichen Teil der Erdatmosphäre ausmacht. Dieses Molekül ist stabil und hat eine unbestimmte Halbwertszeit. (Der natürliche Sauerstoff, den wir atmen, ist eigentlich eine Mischung aus drei stabilen Isotopen: Sauerstoff-16 mit 99,759 Prozent, Sauerstoff-17 mit 0,037 Prozent und Sauerstoff-18 mit einem Anteil von 0,204 Prozent. Diese Isotope haben eine Halbwertszeit von nicht länger als etwa 124 Sekunden).
Singulett-Sauerstoff:
Singulett-Sauerstoff ist (1O2). Es ist ein hochreaktives Molekül, das in Wasser eine Halbwertszeit von ~3,5 s aufweist. Singulett-Sauerstoff ist die gebräuchliche Bezeichnung für einen elektronisch angeregten Zustand von molekularem Sauerstoff (O2), der weniger stabil ist als der normale Triplett-Sauerstoff (O3). Aufgrund seiner ungewöhnlichen Eigenschaften kann Singulett-Sauerstoff bei Raumtemperatur über eine Stunde lang persistieren.
Tri-Sauerstoff O3:
Tri-Sauerstoff wird gewöhnlich als „Ozon“ oder „diradikaler Triplett-Sauerstoff“ bezeichnet und ist ein sehr reaktives Allotrop von Sauerstoff, das bei höherer Dosierung das Lungengewebe schädigen kann. Ozon wird erzeugt, wenn ultraviolettes Licht oder ein elektrischer Funke durch Luft oder Sauerstoff dringt. Es ist ein sehr reaktives Gas, das auch freie Radikale erzeugt. Die Halbwertszeit beträgt etwa 30 Minuten. Es zerfällt schnell zu Dio-Sauerstoff (O2) und monoatomarem Sauerstoff (O1).
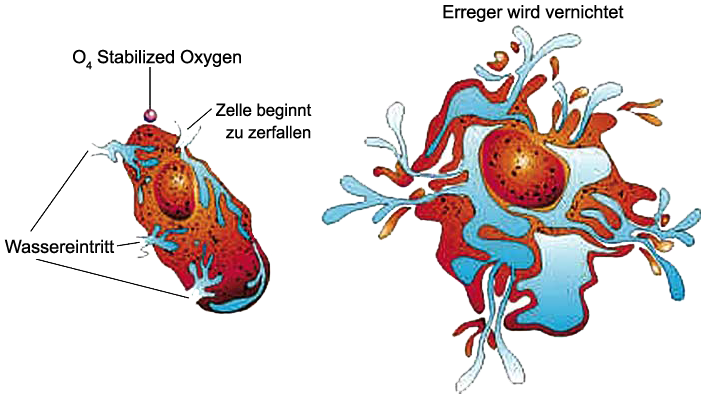
TetraSauerstoff O4:
Die Existenz des metastabilen Moleküls Tetraoxygen (O4) wurde 2001 bestätigt. Es wurde 2006 nachgewiesen, dass dieses Molekül, das durch Druckverstärkung von O2 auf 20 GPa (= 200.000 Bar) entsteht, in Wirklichkeit ein rhomboedrischer O8-Cluster ist. Dieser Cluster hat das Potenzial, ein viel stärkerer Oxidator zu sein als entweder O2 oder O3.
(Metastabil bezieht sich auf einen Energiezustand, in dem sich ein Molekül oder Atom in einem höheren als dem Grundzustand im Gleichgewicht befindet und in dem sich dieser Zustand ändern kann, wenn es mit anderen Molekülen oder Atomen interagiert).
Diese Form der Herstellung wurde in dem Wikipedia Fachbereich beschrieben. Für die Herstellung von unserem O4 Stab. Sauerstoff Hochkonzentrat wird ein abgeändertes Verfahren auf Basis der Elekrolyse und anschließenden Firmeninternen O2 mit O2 Stabilisierung verwendet, die aus Patentrechlichen Gründen nicht genannt werden kann.